Présentation
Auteur(s)
-
Richard PORTIER : Ingénieur de l’École Nationale Supérieure de Chimie de Paris - Professeur à l’Université Paris VI
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le calcul des systèmes polyélectroniques est rendu délicat par le fait qu’il n’existe pas de solutions analytiques exactes. Il convient donc d’utiliser des méthodes de résolutions approximatives et l’article Systèmes polyélectroniques modèles a permis de les présenter. Ainsi, l’approximation monoélectronique, pour laquelle chaque électron est décrit par une fonction qui ne dépend que de ses coordonnées, conduit à des équations dites de champ moyen où les répulsions interélectrons ne sont pas traitées de manière instantanée mais sont en fait moyennées. De plus, dans le cadre de cette approximation, les fonctions monoélectroniques de la molécule, les orbitales moléculaires, peuvent être développées sur une base formée par un nombre fini d’orbitales atomiques des atomes qui composent la molécule. Cette méthode a été testée sur l’ion moléculaire
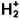 pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(201 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
6. Molécules triatomiques
Deux molécules triatomiques sont étudiées. Dans H2O, les atomes d’hydrogène ne font intervenir que des orbitales 1s de symétrie sphérique, tandis que pour NO2 , les deux oxygènes utilisent les orbitales 2s et 2p .
Nous discutons aussi de la géométrie de la molécule, la forme à l’équilibre étant celle qui correspond à l’énergie la plus basse.
6.1 Molécule H2O
La molécule d’eau a été largement étudiée tant du point de vue théorique que du point de vue expérimental. C’est une molécule de forme coudée (figure 28).
HAUT DE PAGE6.1.1 Construction du diagramme d’orbitales moléculaires
Choisissons un référentiel (figure 29).
La molécule est invariante par E , C 2 [z ] , σx z , σy z . Son groupe ponctuel est C 2v :
Les orbitales atomiques de la base sont :

L’atome d’oxygène est invariant par l’action d’une opération quelconque du groupe ponctuel. Ses orbitales atomiques sont déjà adaptées à la symétrie et forment des bases de représentations irréductibles (tableau 12) :
-
1s , 2s , 2pz pour A 1 ;
-
2px pour B 1 ;
-
2py pour B 2 .
Les atomes d’hydrogène sont invariants ou échangés, ce sont donc des combinaisons linéaires de ha et de hb qui forment des bases. On peut facilement montrer que :
-
ha + hb est base pour A 1 ;
-
ha – hb est base pour B 1 .
- ...
Cet article fait partie de l’offre
Physique Chimie
(201 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Molécules triatomiques
Cet article fait partie de l’offre
Physique Chimie
(201 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










