Présentation
Auteur(s)
-
Richard PORTIER : Ingénieur de l’École Nationale Supérieure de Chimie de Paris - Professeur à l’Université Paris VI
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le calcul des systèmes polyélectroniques est rendu délicat par le fait qu’il n’existe pas de solutions analytiques exactes. Il convient donc d’utiliser des méthodes de résolutions approximatives et l’article Systèmes polyélectroniques modèles a permis de les présenter. Ainsi, l’approximation monoélectronique, pour laquelle chaque électron est décrit par une fonction qui ne dépend que de ses coordonnées, conduit à des équations dites de champ moyen où les répulsions interélectrons ne sont pas traitées de manière instantanée mais sont en fait moyennées. De plus, dans le cadre de cette approximation, les fonctions monoélectroniques de la molécule, les orbitales moléculaires, peuvent être développées sur une base formée par un nombre fini d’orbitales atomiques des atomes qui composent la molécule. Cette méthode a été testée sur l’ion moléculaire
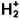 pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
4. Molécules diatomiques homonucléaires
Ces molécules très simples permettent de présenter la construction du diagramme des niveaux monoélectroniques à partir d’arguments de théorie des groupes.
4.1 Étude générale
Nous allons, sans calcul, proposer un diagramme des niveaux monoélectroniques de telles molécules. Nous nous situons dans le cadre de la méthode LCAO‐MO et nous utilisons la théorie des groupes.
Dans un premier temps, nous cherchons les éléments de symétrie de la molécule repérée dans un référentiel, chaque atome possédant son propre référentiel par rapport auquel nous pouvons repérer ses orbitales atomiques (figure 12). Ce choix nous appartient, il est raisonnable de prendre des référentiels qui, sous l’action des opérations de symétrie, se transforment simplement les uns dans les autres.
La molécule est invariante par :
-
l’identité E ;
-
une rotation d’un angle quelconque autour de l’axe z noté C∞ ;
-
une infinité de miroirs passant par l’axe z : ∞ σv ;
-
un centre d’inversion i ;
-
une rotation inversion d’un angle quelconque passant par z : S∞ ;
-
une infinité d’axes binaires passant par O et perpendiculaires à l’axe z : ∞ C2 ;
c’est donc un groupe qui possède une infinité d’opérations de symétrie :
 . Il est caractérisé par la table de caractères (tableau 5).
. Il est caractérisé par la table de caractères (tableau 5).
Il s’agit, dans un second temps, de chercher les représentations irréductibles pour lesquelles les orbitales atomiques constituent des bases. Les orbitales atomiques occupées dans les atomes, si nous nous limitons à la deuxième ligne de classification, sont au plus :
Les orbitales pour les deux atomes sont donc repérées...
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Molécules diatomiques homonucléaires
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










