Présentation
Auteur(s)
-
Richard PORTIER : Ingénieur de l’École Nationale Supérieure de Chimie de Paris - Professeur à l’Université Paris VI
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le calcul des systèmes polyélectroniques est rendu délicat par le fait qu’il n’existe pas de solutions analytiques exactes. Il convient donc d’utiliser des méthodes de résolutions approximatives et l’article Systèmes polyélectroniques modèles a permis de les présenter. Ainsi, l’approximation monoélectronique, pour laquelle chaque électron est décrit par une fonction qui ne dépend que de ses coordonnées, conduit à des équations dites de champ moyen où les répulsions interélectrons ne sont pas traitées de manière instantanée mais sont en fait moyennées. De plus, dans le cadre de cette approximation, les fonctions monoélectroniques de la molécule, les orbitales moléculaires, peuvent être développées sur une base formée par un nombre fini d’orbitales atomiques des atomes qui composent la molécule. Cette méthode a été testée sur l’ion moléculaire
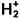 pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(201 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
11. De la molécule isolée au solide
Les arguments développés pour l’étude des molécules peuvent être facilement étendus au cas du solide.
L’étude de la cohésion du solide constitue un problème considérable dès lors que l’on réalise que si nous sommes capables d’écrire exactement le hamiltonien coulombien qui décrit toutes les interactions entre particules, nous sommes incapables de le résoudre exactement. Il faut, en effet, considérer un nombre de particules de l’ordre de 1023 et, comme nous l’avons indiqué pour les molécules, à partir de deux particules, il n’y a pas de solution exacte.
Néanmoins, des méthodes approximatives ont été dérivées et permettent, avec une bonne concordance, de représenter la liaison dans le solide. Nous ne les décrirons pas ici (article L’état métallique. Structure électronique et propriétés physiques [M 40] du traité Matériaux métalliques). Le seul point que nous développerons concerne la filiation que l’on peut établir entre les molécules isolées et le solide cristallin, dès lors que ce sont les électrons externes qui sont responsables des liaisons dans le solide et, de ce fait, qui contrôlent sa cohésion.
Ainsi, de la même manière que les niveaux moléculaires ont été construits à partir des niveaux atomiques, les niveaux monoélectroniques du solide peuvent être construits avec des orbitales de valence des atomes qui le composent. Nous formons, à partir de N niveaux atomiques, N niveaux monoélectroniques pour le solide. Nous concevons tout de suite une difficulté considérable. Les distances entre atomes sont comparables à celles qui existent dans les molécules.
Donc, les ordres de grandeur de la stabilisation du niveau le plus haut et de la déstabilisation du niveau le plus antiliant sont comparables à ce qui existe dans les molécules. Or, entre ces deux niveaux extrêmes, il faut loger de l’ordre de 1023 niveaux. Nous obtenons ainsi un ensemble discret de niveaux qui forme un quasi-continuum et il faut introduire une nouvelle notion pour repérer leur distribution :...
Cet article fait partie de l’offre
Physique Chimie
(201 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
De la molécule isolée au solide
Cet article fait partie de l’offre
Physique Chimie
(201 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










