Présentation
Auteur(s)
-
Richard PORTIER : Ingénieur de l’École Nationale Supérieure de Chimie de Paris - Professeur à l’Université Paris VI
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le calcul des systèmes polyélectroniques est rendu délicat par le fait qu’il n’existe pas de solutions analytiques exactes. Il convient donc d’utiliser des méthodes de résolutions approximatives et l’article Systèmes polyélectroniques modèles a permis de les présenter. Ainsi, l’approximation monoélectronique, pour laquelle chaque électron est décrit par une fonction qui ne dépend que de ses coordonnées, conduit à des équations dites de champ moyen où les répulsions interélectrons ne sont pas traitées de manière instantanée mais sont en fait moyennées. De plus, dans le cadre de cette approximation, les fonctions monoélectroniques de la molécule, les orbitales moléculaires, peuvent être développées sur une base formée par un nombre fini d’orbitales atomiques des atomes qui composent la molécule. Cette méthode a été testée sur l’ion moléculaire
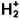 pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
10. Facteurs orbitalaires en chimie organique
L’utilisation de facteurs orbitalaires a permis de comprendre les mécanismes de réactions que des facteurs électrostatiques ou stériques ne permettaient pas de justifier. Cette analyse est basée sur les orbitales frontières : la plus haute occupée et la plus basse inoccupée.
La grande réactivité des systèmes conjugués conduit à une large variété de réactions chimiques dans lesquelles ils sont impliqués. Pour ces réactions, il est essentiel d’être capable de proposer un mécanisme. Nous distinguons des réactions qui ne font intervenir qu’une molécule et qui sont appelées réactions intramoléculaires de celles qui en impliquent plusieurs et qui sont des réactions intermoléculaires.
Jusque vers les années soixante‐cinq, les arguments utilisés pour décrire des mécanismes réactionnels possibles étaient essentiellement de deux natures :
-
les facteurs électrostatiques basés sur la répartition des charges sur les molécules et donc sur des règles d’interactions électrostatiques ;
-
les facteurs stériques basés sur l’encombrement spatial des molécules.
De ce fait, un grand nombre de réactions chimiques qui ne pouvaient s’expliquer à partir de tels arguments étaient qualifiées de réactions sans mécanisme.
C’est l’introduction de la mécanique quantique via les facteurs orbitalaires qui a débloqué la situation dans de nombreux cas. Cela a été largement conduit par les travaux de Woodward et Hoffmann. En fait, il faut considérer l’intervention de ces trois arguments et il est clair que si, du point de vue des orbitales, une réaction est permise, elle peut être interdite en réalité dès lors que l’encombrement des molécules est trop important. Nous allons, sans prétention exhaustive, examiner quelques cas.
10.1 Exemple de réactions électrocycliques intramoléculaires
Nous désignons ainsi des réactions de fermeture de chaînes ou d’ouverture de cycles sous l’influence de la température ou sous irradiation.
Par exemple, la cyclisation du diméthyl 1‐6 hexatriène conduit à deux molécules cycliques isomères selon que la réaction s’effectue sous l’action de la température ou sous irradiation (figure 65).
De tels...
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Facteurs orbitalaires en chimie organique
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










