Présentation
Auteur(s)
-
Richard PORTIER : Ingénieur de l’École Nationale Supérieure de Chimie de Paris - Professeur à l’Université Paris VI
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le calcul des systèmes polyélectroniques est rendu délicat par le fait qu’il n’existe pas de solutions analytiques exactes. Il convient donc d’utiliser des méthodes de résolutions approximatives et l’article Systèmes polyélectroniques modèles a permis de les présenter. Ainsi, l’approximation monoélectronique, pour laquelle chaque électron est décrit par une fonction qui ne dépend que de ses coordonnées, conduit à des équations dites de champ moyen où les répulsions interélectrons ne sont pas traitées de manière instantanée mais sont en fait moyennées. De plus, dans le cadre de cette approximation, les fonctions monoélectroniques de la molécule, les orbitales moléculaires, peuvent être développées sur une base formée par un nombre fini d’orbitales atomiques des atomes qui composent la molécule. Cette méthode a été testée sur l’ion moléculaire
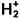 pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
8. Complexes d’éléments de transition
Cet important domaine de la chimie est traité par la méthode des orbitales moléculaires. Nous pouvons à partir des diagrammes des niveaux monoélectroniques prévoir raisonnablement des propriétés des complexes en fonction de la nature des ligands et du nombre d’électrons du métal de transition.
Les métaux de transition donnent des complexes avec des ions ou des molécules que l’on appelle des ligands.
Les ligands conservent, plus ou moins modifiées, les propriétés qu’ils ont à l’état libre ; par contre, l’ion du métal de transition a des propriétés largement modifiées.
Plusieurs théories ont été proposées afin de décrire les complexes. Les éléments de transition font intervenir des orbitales atomiques s, p et d .
8.1 Théorie du champ cristallin
Ce modèle (Bethe 1929) suppose un complexe ionique : le métal de transition est sous forme cationique et les ligands sont chargés négativement. Il y a interaction électrostatique entre le cation et les charges négatives des ligands qui sont supposées localisées. Le métal sous forme cationique a subi une brisure de symétrie ; le cation libre est dans un environnement isotrope et ses orbitales atomiques sont dégénérées (niveau s non dégénéré) :
-
d’ordre 3 pour p ;
-
d’ordre 5 pour d .
La présence des ligands change la symétrie et peut lever la dégénérescence et cela d’autant plus que la répulsion électrostatique est plus forte.
Examinons la situation pour les cinq orbitales atomiques d .
Dans le cas d’un complexe octaédrique, les charges négatives sont situées aux sommets d’un octaèdre (figure 43).
Parmi les cinq orbitales d, deux pointent vers les anions
 et
et
 , les trois autres pointent entre ces ions. Le premier groupe subit donc une plus forte répulsion que le second et la levée de dégénérescence s’établit ainsi :
, les trois autres pointent entre ces ions. Le premier groupe subit donc une plus forte répulsion que le second et la levée de dégénérescence s’établit ainsi :
 ...
...
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Complexes d’éléments de transition
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










