Présentation
Auteur(s)
-
Paul Victor RIBOUD : Ingénieur Civil des Mines de Nancy, Docteur ès Sciences - Adjoint au Chef du Département de Physico-Chimie Métallurgique de l’IRSID (Maizières-lès-Metz)
-
Jean-Marc STEILER : Ingénieur Civil des Mines de Nancy, Docteur Ingénieur - Chef de Section au Département de Physico-Chimie Métallurgique de l’IRSID (Maizières-lès-Metz)
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Cet article met à la disposition des sidérurgistes l’ensemble des données thermochimiques nécessaires à l’établissement des bilans thermiques en pyrométallurgie et en particulier en sidérurgie.
Les données sont issues des compilations les plus récentes et en particulier des fichiers de la Banque de données thermochimiques exploités à la Station d’Essais de l’IRSID à Maizières-lès-Metz.
Ces données, exprimées dans les unités du système international (SI), sont pour la plupart présentées sous forme de tables générées automatiquement par ordinateur.
Le présent texte rassemble les données suivantes :
-
variation d’enthalpie des corps purs (éléments et composés) entre 25 oC et t oC ;
-
température et variation d’enthalpie des transformations de phase des corps purs ;
-
enthalpie de formation des composés à diverses températures ;
-
enthalpie de dissolution des éléments dans le fer liquide.
Par ailleurs, un paragraphe est consacré à la présentation des données thermochimiques relatives à des corps industriels complexes particulièrement importants en sidérurgie : laitiers liquides et solides, combustibles solides, liquides et gazeux, coke métallurgique et fonte solide et liquide.
Des exemples concrets d’utilisation des données en sidérurgie sont finalement traités.
Le bilan thermique d’un processus est l’une des étapes importantes dans l’étude d’un réacteur industriel. Les tableaux ci-après comportent les données thermochimiques nécessaires pour effectuer les calculs de bilans thermiques en pyrométallurgie et plus particulièrement en sidérurgie.
Ces données sont exprimées sous la forme de variation d’enthalpie du système considéré au cours d’élévations de température ou de réactions chimiques. Les valeurs sont extraites de la Banque de données thermochimiques Thermodata et des autres compilations thermochimiques disponibles dans la littérature .
Dans la première partie de cet article, le système étudié est constitué d’un corps pur que l’on échauffe entre 25 oC et une température t.
Dans la deuxième partie, le système est constitué de plusieurs corps qui réagissent entre eux dans des proportions stœchiométriques pour former un composé, réactifs et produits se trouvant à la même température t.
Les paragraphes suivants concernent le cas des phases plus complexes : solutions métalliques, laitiers et combustibles industriels. Des exemples d’utilisation des données en sidérurgie sont ensuite présentés.
Conformément aux dispositions légales, les unités choisies sont celles du système international (SI). En particulier, la seule unité d’énergie utilisée est un multiple du joule (J) :
Les données thermochimiques étaient autrefois exprimées en calories (calth ). La conversion utilise la relation :
Les températures, exprimées en degrés Celsius, sont déduites de l’échelle thermodynamique Kelvin, conformément à l’échelle internationale pratique de température EIPT 68.
Pour faciliter l’utilisation des tables, les données enthalpiques ont été rapportées, suivant le cas, au kilogramme de corps pur que l’on échauffe ou au kilogramme de produit de la réaction isotherme considérée. Cela doit bien entendu guider l’organisation des calculs des bilans matières qui précèdent nécessairement ceux du bilan thermique.
Dans le cas des gaz, le fait de rapporter les enthalpies à l’unité de masse permet d’éviter, à ce stade des calculs, les problèmes de volume massique des gaz réels dans les conditions normales (t = 0 oC, p = 1,013 bar).
À haute température, lorsque les gaz se rapprochent suffisamment de l’idéalité, leur volume peut être calculé simplement, connaissant le volume molaire Vmol des gaz :
D’où le volume V (m3) d’une masse M de gaz parfait (masse molaire Mmol ) à la température t ( oC) sous la pression p (bar) :
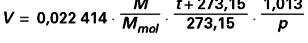
M et Mmol étant exprimées dans la même unité.
Les tableaux 4 et 17 ont été cependant ajoutés, en rapportant l’enthalpie au volume de gaz mesuré dans les conditions normales pour un petit nombre de corps stables à l’état gazeux dans les conditions normales.
La définition de l’enthalpie et les rappels théoriques concernant en particulier le premier principe de la thermodynamique sont présentés dans les articles de la rubrique Thermodynamique du traité Sciences fondamentales et dans l’article Formalisme et principes de la thermodynamique [AF 4 040] du même traité.
Convention de signe : rappelons la convention de signe qui découle du choix, fait ici, de la variation d’enthalpie du système pour exprimer les variations d’énergie se produisant au cours des transformations : la variation d’énergie est comptée positivement quand le système a reçu de l’énergie pour passer de l’état 1 à l’état 2 (ΔH est positif pour une réaction endothermique).
Conventions d’écriture : dans tout le texte, H désigne la fonction enthalpie du corps considéré. Le symbole o indique que le corps se trouve dans son état standard défini dans l’article Équilibres thermodynamiques dans l’élaboration de la fonte et de l’acier . Un astérisque (*), ou un renvoi, signale les exceptions : les corps considérés sont dans un état métastable ou un état fictif choisi pour la commodité des calculs. ΔH o désigne la variation d’enthalpie au cours d’une réaction, réactifs et produits se trouvant dans leur état standard.
Dans tous les tableaux, sauf 3 à 6 et 16 à 18, les valeurs d’enthalpie à la température t sont écrites en caractères romains lorsque le corps étudié est solide. Elles sont écrites en italique entre crochets lorsqu’il se trouve à l’état liquide, en caractère demi-gras lorsqu’il est à l’état gazeux. Les données concernant les changements d’état sont rassemblées dans les tableaux 12, 13 et 14.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Élaboration et recyclage des métaux
(120 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Enthalpie des corps purs
1.1 Variation d’enthalpie des corps entre 25 oC et diverses températures
HAUT DE PAGE
1.2 Enthalpie de transformation des corps purs
HAUT DE PAGE
Cet article fait partie de l’offre
Élaboration et recyclage des métaux
(120 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Enthalpie des corps purs
BIBLIOGRAPHIE
-
(1) - Banque de données thermochimiques. - [Cette banque de données thermochimiques sélectionnées et critiquées a été créée par le groupe de thermochimistes européens SGTE (Scientific Group Thermodata Europe) qui assure la remise à jour permanente des fichiers de données. La banque peut être consultée en France auprès des organismes suivants : THERMODATA ; IRSID].
-
(2) - JANAF Thermochemical tables. - 2e Ed. US Dept Commerce NSB (1971) ; J. Phys. Chem. Ref. Data, 3, no 2, p. 311 (1974) ; J. Phys. Chem. Ref., Data, 4, no 1, p. 1 (1975).
-
(3) - BARIN (I.), KNACKE (O.) - Thermochemical properties of inorganic substances. - Springer Verlag (1973).
-
(4) - BARIN (I.), KNACKE (O.), KUBASCHEWSKI (O.) - Thermochemical properties of inorganic substances. - Supplément, Springer Verlag (1977).
-
(5) - FERRIER (A.), OLETTE (M.) - Mesure de la capacité calorifique du fer entre 910 et 1937 oC. - CR Acad. Sci. Paris, 255, p. 2322-4 (1962).
- ...
Cet article fait partie de l’offre
Élaboration et recyclage des métaux
(120 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










