Présentation
RÉSUMÉ
Cet article, consacré à la cinétique électrochimique, rappelle tout d’abord quelques notions de thermodynamique qui permettent de caractériser un système à l’équilibre. Les définitions des grandeurs (potentiel d’électrode, coefficient d’activité) couramment utilisées dans ce domaine et les relations qui régissent les transferts mono- et polyélectroniques, entre autres la loi empirique de Tafel et la loi de Butler-Volmer, sont ensuite détaillées et explicitées. Les applications sont retrouvées essentiellement dans les procédés industriels (générateurs, phénomène de corrosion).
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Didier DEVILLIERS : Professeur Laboratoire LI2C – Électrolytes et électrochimie Université Pierre-et-Marie-Curie – Paris 6
INTRODUCTION
La cinétique joue un rôle essentiel en industrie électrochimique préparative, dans le domaine des générateurs électrochimiques et dans celui de la corrosion. Dans ce dossier de mise au point, nous avons rassemblé, en peu de pages, les définitions précises des grandeurs couramment utilisées en cinétique électrochimique, leur signification physique et les applications principales qui en découlent en électroanalyse et dans les procédés industriels ; enfin, nous avons illustré nos propos par une série de données expérimentales utiles à l'ingénieur, mais aussi au chercheur.
Nous avons rappelé tout d'abord quelques notions de thermodynamique. En effet, avant d'étudier la cinétique d'une réaction, qui correspond à un état hors d'équilibre du système, il est essentiel de bien décrire le système à l'équilibre. La notion de surtension, par exemple, exige la connaissance des potentiels d'électrode à l'équilibre.
VERSIONS
- Version archivée 1 de juin 1962 par Didier DEVILLIERS, Marius CHEMLA
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
4. Corrosion électrochimique
4.1 Potentiel de corrosion. Courant de corrosion
La corrosion d'un métal M est le phénomène spontané d'oxydation de ce métal, sous l'influence d'un agent oxydant présent dans son environnement. L'équation-bilan s'applique, dans laquelle le couple Ox1/Red1 s'identifie à Mn+/M.
Dans le cas de l'oxydation « par voie sèche » le couple Ox2/Red2 s'identifie au couple O2/O2− ; un oxyde solide se forme uniformément à la surface de l'échantillon.
Dans le cadre de ce paragraphe, nous nous intéressons à la corrosion électrochimique (« par voie humide »), correspondant au cas où le métal est placé en contact avec une solution aqueuse. Le deuxième couple Ox2/Red2 s'identifie à O2(dissous)/H2O ou à H+/H2. On peut alors observer une oxydation très localisée, dangereuse pour la pièce métallique.
Le potentiel d'abandon de l'électrode métallique plongée dans la solution est un potentiel mixte appelé potentiel de corrosion Ecor. À ce potentiel, le courant total qui s'écoule est nul car les composantes anodique Ia1 et cathodique Ic2 se compensent exactement. On appelle courant de corrosion, Icor, la valeur commune de Ia1 et de | Ic2 | au potentiel de corrosion.
Son expression découle de l'équation :
Dans cette relation, on a introduit les deux surtensions ηcor i :
Dans le cas simple de deux réactions monoélectroniques possédant chacune un coefficient de transfert égal à 0,5, on obtient :
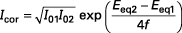
La valeur numérique de Icor pour un métal au contact d'un électrolyte particulier renseigne sur la cinétique de corrosion. Elle peut s'estimer grâce au tracé des courbes I-E et à leur exploitation selon la méthode de Tafel, qui est valide si Ecor est suffisamment différent de Eeq1 et Eeq2...
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Corrosion électrochimique
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










