Présentation
RÉSUMÉ
Cet article, consacré à la cinétique électrochimique, rappelle tout d’abord quelques notions de thermodynamique qui permettent de caractériser un système à l’équilibre. Les définitions des grandeurs (potentiel d’électrode, coefficient d’activité) couramment utilisées dans ce domaine et les relations qui régissent les transferts mono- et polyélectroniques, entre autres la loi empirique de Tafel et la loi de Butler-Volmer, sont ensuite détaillées et explicitées. Les applications sont retrouvées essentiellement dans les procédés industriels (générateurs, phénomène de corrosion).
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Didier DEVILLIERS : Professeur Laboratoire LI2C – Électrolytes et électrochimie Université Pierre-et-Marie-Curie – Paris 6
INTRODUCTION
La cinétique joue un rôle essentiel en industrie électrochimique préparative, dans le domaine des générateurs électrochimiques et dans celui de la corrosion. Dans ce dossier de mise au point, nous avons rassemblé, en peu de pages, les définitions précises des grandeurs couramment utilisées en cinétique électrochimique, leur signification physique et les applications principales qui en découlent en électroanalyse et dans les procédés industriels ; enfin, nous avons illustré nos propos par une série de données expérimentales utiles à l'ingénieur, mais aussi au chercheur.
Nous avons rappelé tout d'abord quelques notions de thermodynamique. En effet, avant d'étudier la cinétique d'une réaction, qui correspond à un état hors d'équilibre du système, il est essentiel de bien décrire le système à l'équilibre. La notion de surtension, par exemple, exige la connaissance des potentiels d'électrode à l'équilibre.
VERSIONS
- Version archivée 1 de juin 1962 par Didier DEVILLIERS, Marius CHEMLA
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
2. Aspects théoriques
2.1 Rappels de thermodynamique
2.1.1 Réaction électrochimique
Les techniques électrochimiques modernes permettent d'étudier le mécanisme du transfert électronique faisant intervenir les deux espèces Ox et Red (supposées solubles) appartenant à un couple rédox Ox/Red au contact d'une électrode. Dans ce qui suit, on suppose qu'il s'agit d'une électrode plane. La demi-réaction électrochimique s'écrit :
 ( 1 )
( 1 )
Ci-dessous, on adoptera les indices « Ox » ou « R » pour les deux espèces Ox et Red respectivement.
La réaction de transfert électronique simple a lieu à l'interface électrode/solution, l'électrode étant un conducteur électronique qui joue le rôle de source ou de puits d'électrons.
HAUT DE PAGE
-
Le potentiel d'équilibre Eeq de l'électrode, siège de la réaction , est donné par la relation de Nernst :
![]() ( 2 )
( 2 )
avec :
- Eo :
- potentiel standard du couple (V),
- f = F /RT :
- pour simplifier l'écriture (V−1),
- F :
- constante de Faraday (F = 96 485 C · mol−1),
- R :
- constante molaire des gaz parfaits (R = 8,314 4 J · mol−1 · K−1),
...
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Aspects théoriques
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive









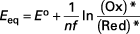 ( 2 )
( 2 )

