Présentation
Auteur(s)
-
Fethi BEDIOUI : Ingénieur ENSCP (École nationale supérieure de chimie de Paris) - Docteur ès Sciences - Directeur de recherche au CNRS
-
Sophie GRIVEAU : Docteur de l'université Pierre-et-Marie-Curie, - Maître de conférences à l'ENSCP (École nationale supérieure de chimie de Paris)
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
N ous limiterons notre étude ici aux électrodes indicatrices solides.
Lorsque la réaction électrochimique n'est pas un simple transfert électronique, mais une réaction complexe, il est nécessaire de prendre en compte la vitesse des processus associés au transfert électronique (réaction chimique, adsorption). La relation potentiel-concentration est toujours donnée par la loi de Butler-Volmer, mais les concentrations à l'électrode
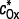 et
et
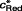 sont fonction des vitesses des processus associés au transfert électronique et/ou des paramètres d'adsorption (taux de recouvrement, par exemple). L'intégration des équations de diffusion doit prendre en compte les caractéristiques cinétiques de ces phénomènes.
sont fonction des vitesses des processus associés au transfert électronique et/ou des paramètres d'adsorption (taux de recouvrement, par exemple). L'intégration des équations de diffusion doit prendre en compte les caractéristiques cinétiques de ces phénomènes.
L'objet de cet article est de décrire l'évolution des voltampérogrammes des systèmes électrochimiques par action de réactifs chimiques (électroactifs ou non) présents en solution. Cette évolution peut consister, dans certaines conditions, en une simple translation des voltampérogrammes le long de l'axe de potentiel et/ou une amplification de l'intensité de l'électrolyse, fonction de la réactivité chimique mise en jeu. Ainsi, ces caractéristiques de modification de voltampérogrammes peuvent être révélatrices de la présence d'un réactif non électroactif et permettre d'en déterminer indirectement la teneur.
VERSIONS
- Version archivée 1 de mars 1999 par Fethi BEDIOUI
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Techniques d'analyse
(288 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
4. Effets des phénomènes d'adsorption
Certaines réactions nécessitent une adsorption préalable de réactifs ou d'espèces intermédiaires à la surface de l'électrode. Le cas le plus étudié est celui de la réduction des ions H+, qui peut être décrit de la façon suivante :

suivi de :

ou de :

L'adsorption fait jouer un rôle particulièrement important à la surface de l'électrode qui apparaît ainsi comme capable d'abaisser l'énergie d'activation de certaines réactions, donc de catalyser ces réactions. L'électrocatalyse rassemble les phénomènes faisant intervenir la surface de l'électrode comme catalyseur (ne pas confondre avec la catalyse électroassistée, pour laquelle l'électrode intervient pour générer des espèces catalytiques, les réactions se déroulant en solution).
L'adsorption peut également concerner des espèces qui ne sont pas directement impliquées dans les réactions, comme c'est fréquemment le cas en électrochimie organique. Elle provoque alors des modifications de surface de l'électrode qui compliquent souvent l'étude des réactions.
L'utilisation des isothermes de Langmuir, de Temkin ou de Frumkin permet, dans le cas où les espèces électroactives Ox ou Red sont adsorbées, d'établir l'expression de la concentration de ces espèces à la surface de l'électrode en fonction de leur concentration respective en solution. Le développement mathématique global de la caractérisation électrochimique, par voltampérométrie cyclique, d'espèces électroactives adsorbées à la surface d'une électrode solide a été largement étudié par Laviron [14]....
Cet article fait partie de l’offre
Techniques d'analyse
(288 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Effets des phénomènes d'adsorption
ANNEXES
###
HAUT DE PAGE
À lire également dans nos bases (articles TI)
BEDIOUI (F.) - Voltampérométrie. Théorie et mise en œuvre expérimentale. - [P 2 126] (1999).
HAUT DE PAGE
Références bibliographiques
TREMILLON (B.) - Électrochimie analytique et réactions en solution. - Tome 1, Masson, Paris (1993).
A. RINGBOM (A.) - Les complexes en chimie analytique. - Dunod, Paris (1967).
ATKINS (J.W.) - JONES (L.) - Principes de la chimie. - De Boeck & Larcier (2008).
POURBAIX (M.) - Atlas d'équilibres électrochimiques. - Gauthier-Villars (1963).
BARD (A.J.) - PARSONS (R.) - JORDAN (T.) - Standard Potentials in aqueous solutions. - Ed. M. Dekker (1985).
BADOZ-LAMBLING (J.) - * - Bull. Soc. Chim. France, 370 (1954).
SAVÉANT (J.M.) - Elements of molecular and biomolecular electrochemistry. - Wiley Interscience, Hoboken (2006).
BEDIOUI (F.) - Étude électrochimique de complexes de métaux de transition (bases de Schiff et porphyrines) en solution et sous forme d'électrodes modifiées. Application à la catalyse électroassistée de réactions organiques. - Thèse de Doctorat ès Sciences Physiques, Université Pierre et Marie Curie, Paris VI (1986).
NICHOLSON (R.S.) - SHAIN (I.) - Theory of stationnary electrode polarography....
Cet article fait partie de l’offre
Techniques d'analyse
(288 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










