Présentation
Auteur(s)
-
Fethi BEDIOUI : Ingénieur ENSCP (École Nationale Supérieure de Chimie de Paris) - Docteur ès Sciences - Directeur de recherche au CNRS
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Nous limiterons notre étude ici aux électrodes indicatrices solides.
Lorsque la réaction électrochimique n’est pas un simple transfert électronique, mais une réaction complexe, il est nécessaire de prendre en compte la vitesse des processus associés au transfert électronique (réaction chimique, adsorption). La relation potentiel-concentration est toujours donnée par la loi de Butler-Volmer, mais les concentrations à l’électrode
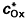 et
et
 sont fonction des vitesses des processus associés au transfert électronique et/ou des paramètres d’adsorption (taux de recouvrement, par exemple). L’intégration des équations de diffusion doit prendre en compte les caractéristiques cinétiques de ces phénomènes. Un choix judicieux des conditions expérimentales, permet, dans certains cas, de faire apparaître une limitation du courant d’électrolyse ou un déplacement du potentiel, liés à la vitesse d’une réaction chimique qui peut ainsi être étudiée. Il est d’usage de classer les réactions chimiques couplées au transfert de charge comme il est indiqué dans le tableau 1. L’indice r, q, i, qui affecte l’échange électronique se rapporte aux cas évoqués dans la première partie de cet article (transfert électronique, r : rapide (ou réversible) ; q : quasi rapide et i : lent (ou irréversible)). Les réactions chimiques couplées peuvent être réversibles (r) ou irréversibles (i).
sont fonction des vitesses des processus associés au transfert électronique et/ou des paramètres d’adsorption (taux de recouvrement, par exemple). L’intégration des équations de diffusion doit prendre en compte les caractéristiques cinétiques de ces phénomènes. Un choix judicieux des conditions expérimentales, permet, dans certains cas, de faire apparaître une limitation du courant d’électrolyse ou un déplacement du potentiel, liés à la vitesse d’une réaction chimique qui peut ainsi être étudiée. Il est d’usage de classer les réactions chimiques couplées au transfert de charge comme il est indiqué dans le tableau 1. L’indice r, q, i, qui affecte l’échange électronique se rapporte aux cas évoqués dans la première partie de cet article (transfert électronique, r : rapide (ou réversible) ; q : quasi rapide et i : lent (ou irréversible)). Les réactions chimiques couplées peuvent être réversibles (r) ou irréversibles (i).
L’exploitation quantitative des processus cinétiques associés résulte donc de la prise en compte de la vitesse de transfert électronique et de la vitesse de la (ou des) réaction(s) associée(s). Les équations cinétiques théoriques doivent être établies dans les 3 cas évoqués dans la première partie, à savoir : transfert électronique rapide, quasi rapide ou lent. Il en résulte une grande diversité de situations dont seules quelques-unes des plus simples sont examinées ici. L’analyse des processus électrochimiques comprend donc :
-
l’étude des paramètres cinétiques du transfert électronique, lorsque celui-ci peut-être isolé des phénomènes couplés ;
-
l’étude cinétique des processus associés au transfert électronique ; cette étude implique un choix des méthodes expérimentales et des conditions d’exploitation compatibles avec les paramètres cinétiques qu’il s’agit de mettre en évidence.
Les méthodes d’approche sont variées et plus ou moins bien adaptées aux phénomènes étudiés. La résolution d’un problème passe en général par la combinaison de plusieurs d’entre elles (par exemple voltampérométrie et coulométrie à potentiel contrôlé qui permet de recenser les espèces stables dans les conditions de l’expérience), ou voltampérométrie et impédancemétrie, etc. Le couplage des méthodes électrochimiques et de méthodes optiques ou électromagnétiques apporte aussi des solutions élégantes, de plus en plus souvent proposées.
Les méthodes proposées dans ce chapitre sont les plus couramment utilisées et sont parmi celles qui se prêtent bien à un traitement quantitatif des phénomènes cités ci-dessus. Ce sont :
-
la voltampérométrie en régime de diffusion convective stationnaire qui est très bien adaptée à l’étude thermodynamique des réactions en solution, et en particulier à l’étude des effets de pH et de la complexation ;
-
la voltampérométrie en régime de diffusion pure, et en particulier la voltampérométrie cyclique, mieux adaptée à la mise en évidence d’intermédiaires réactionnels.
L’objet de cet article est de décrire l’évolution des voltampérogrammes des systèmes électrochimiques par action de réactifs chimiques (électroactifs ou non) présents en solution. Cette évolution peut consister, dans certaines conditions, en une simple translation des voltampérogrammes le long de l‘axe de potentiel et/ou une amplification de l’intensité de l’électrolyse, fonction de la réactivité chimique mise en jeu. Ainsi, ces caractéristiques de modification de voltampérogrammes peuvent être révélatrices de la présence d’un réactif non électroactif et permettre d’en déterminer indirectement la teneur.
VERSIONS
- Version archivée 2 de déc. 2008 par Fethi BEDIOUI, Sophie GRIVEAU
- Version courante de déc. 2025 par Fethi BEDIOUI, Sophie GRIVEAU
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Techniques d'analyse
(290 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Effet de changement d’acidité du milieu et de la formation de complexes
La prédiction quantitative des modifications, en fonction des caractéristiques des systèmes chimiques mis en jeu, est effectuée aisément dans le cas où l’on peut appliquer les relations d’équilibre (électrochimique et chimique), c’est-à-dire dans le cas où toutes les réactions sont rapides (par rapport à la diffusion des espèces impliquées). Cela est le cas généralement rencontré dans l’étude de l’action des acides et bases et de réactifs formant des complexes sur les substances électroactives et/ou sur leur produit d’électrolyse. Le traitement est limité dans cette partie à des cas de cette nature où seuls les voltampérogrammes en régime de diffusion convective stationnaire sont considérés (les voltampérogrammes en régime de diffusion pure subissent des modifications semblables).
1.1 Effet du changement de l’acidité du milieu : systèmes du type Ox + m H+ + ne– ⇔ Red
De tels systèmes sont fréquemment rencontrés avec les composés électroactifs organiques. Leur potentiel d’équilibre dépend, non seulement des concentrations de Ox et de Red, mais également du pH.
Remarque : l’analyse des caractéristiques voltampérométriques est la plus simple lorsque le pH de la solution se trouve bien fixé soit par la présence d’un acide fort ou celle d’une base forte, soit par un mélange tampon. Ainsi, on peut admettre que la réaction à l’électrode (consommation de H+ par réduction de Ox ou production de H+ par oxydation de Red, par exemple) n’entraîne qu’une variation négligeable de pH local (à la surface de l’électrode).
Dans le cas d’un mélange tampon, si l’on a affaire à un système rapide Ox + mH+ + ne– ⇔ Red, sa caractéristique voltampérométrique obéit alors à la relation :
 ( 1 )
( 1 )
avec :
 ...
...Cet article fait partie de l’offre
Techniques d'analyse
(290 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Effet de changement d’acidité du milieu et de la formation de complexes
Cet article fait partie de l’offre
Techniques d'analyse
(290 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










