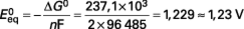Présentation
RÉSUMÉ
L’utilisation de piles à combustible permettrait de réduire fortement les émissions de gaz à effet de serre (dioxyde de carbone) et de gaz nocifs (oxydes d’azote). De plus, leurs rendements élevés en électricité (45 à 50 %) et en cogénération d'électricité, plus chaleur (90 à 95 %), permettrait de réduire considérablement l’importation de combustibles fossiles.
Cet article se propose de rappeler le principe des piles à combustible en se basant sur la thermodynamique et la cinétique des réactions électrochimiques impliquées et de discuter des rendements énergétiques selon les différents combustibles impliqués : hydrogène, gaz naturel, hydrocarbures, méthanol, biomasse, ammoniac, etc. À titre d’exemple, les piles à basse température, utilisant des membranes protoniques ou anioniques, y seront présentées, ainsi que la pile à oxydation directe du méthanol.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Claude LAMY : Professeur émérite, Institut Charles Gerhardt (ICGM), CNRS, université de Montpellier - Membre de France Hydrogène, France
-
Michel CASSIR : Professeur émérite, Chimie ParisTech, université PSL, Institut de Recherche de Chimie Paris (IRCP), France
-
Daniel HISSEL : Professeur, université de Franche-Comté, Institut universitaire de France (IUF), FEMTO-ST, CNRS - Directeur-adjoint Fédération nationale hydrogène du CNRS
-
Gilles TAILLADES : Professeur, directeur de la mention énergie, Institut Charles Gerhardt (ICGM), CNRS, université de Montpellier, France
INTRODUCTION
Depuis leur invention en 1839, les perspectives d’un développement commercial des piles à combustible n’ont jamais été aussi bonnes, par suite des efforts de la recherche, de choix stratégiques de grands groupes industriels, de constructeurs automobiles et en réponse à un contexte environnemental, sociétal et politique en forte évolution.
Le principe général des piles à combustible est d’abord rappelé en évaluant les grandeurs thermodynamiques et cinétiques des réactions électrochimiques impliquées (oxydation du combustible à l’anode, réduction de l’oxygène à la cathode) dans un large domaine de température (25 °C à 1 000 °C) afin d’introduire les piles fonctionnant à basse température et à haute température. Les piles basse température (piles hydrogène/oxygène à membranes et pile à oxydation directe du méthanol) sont ensuite décrites en détails.
Les Piles à membrane échangeuse de protons (PEMFC) ont maintenant atteint des niveaux de maturité technologique importants permettant, au-delà de simples démonstrations, une réelle production industrielle, ainsi que leur commercialisation dans de multiples domaines : production d’énergie électrique stationnaire (bâtiments et centrales électriques, alimentation de secours, groupes électrogènes pour l’événementiel), mobilité terrestre (vélos, véhicules légers, camions, autobus, trains), navigation fluviale et maritime, applications aérospatiales (avion, drones, lanceurs, satellites). Elles ont une bonne compacité en termes de puissance spécifique (> 3 kW · kg–1 et > 3 kW · L–1), de bonnes perspectives de réduction de coût et des durées de vie suffisantes.
Les autres piles (AFC, PAFC, MCFC, SOFC, PCFC), décrites dans les 3 articles associés, ont également un certain nombre d’avantages pour des applications similaires, tandis que les Piles à oxydation directe du méthanol (DMFC) visent essentiellement les applications portables.
MOTS-CLÉS
Cinétique de réaction pile à combustible thermodynamique hydrogène Rendement exergétique Cogénération biomasse ammoniac piles à membranes polymères piles à oxydation directe du méthanol
VERSIONS
- Version archivée 1 de août 2000 par Philippe STEVENS, Frédéric NOVEL-CATTIN, Abdel HAMMOU, Claude LAMY, Michel CASSIR
DOI (Digital Object Identifier)
CET ARTICLE SE TROUVE ÉGALEMENT DANS :
Accueil > Ressources documentaires > Énergies > Hydrogène > Utilisation et valorisation de l'hydrogène > Principe des piles à combustible - Piles à membranes basse température > Description de la pile hydrogène/oxygène
Cet article fait partie de l’offre
Conversion de l'énergie électrique
(263 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
2. Description de la pile hydrogène/oxygène
-
Dans le cas de la pile hydrogène/oxygène (figure 1), la réaction chimique globale, associée à cette transformation, est la combustion de l’hydrogène dans l’oxygène :
![]() ( 2 )
( 2 )
avec production simultanée d’eau, d’énergie électrique W e et de chaleur ΔQ.
Dans l’état standard (T = 25 °C, p = 105 Pa = 1 bar, eau liquide) W e = – ΔG 0 = 237,1 kJ/mole H2, ce qui correspond (avec n = 2 pour l’hydrogène) à une f.é.m. à l’équilibre (courant nul) :
![]()
Le principal intérêt du combustible H2 est que la densité d‘énergie spécifique théorique W s associée à la réaction (2), rapportée à 1 kg d’hydrogène et exprimée en kWh · kg–1, est très élevée, soit, à l’état standard :
![]()
où M = 0,002 kg est la masse molaire de l’hydrogène. Avec un stockage en phase gaz à 700 bars, soit 5 à 6 % massique, cela correspond à une densité d’énergie pratique de l’ordre de 1 650 à 1 980 Wh · kg–1, qui est de l’ordre de 4 à 5 fois plus élevée que celle des batteries au lithium.
À 1 bar et 927 °C, soit 1 200 K (eau à l’état gazeux), la densité d’énergie théorique est plus faible résultant d’une enthalpie libre plus faible...
Cet article fait partie de l’offre
Conversion de l'énergie électrique
(263 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Description de la pile hydrogène/oxygène
BIBLIOGRAPHIE
-
(1) - BOCKRIS (J.O’M.), SRINIVASAN (S.) - Fuel Cells: their electrochemistry. - McGraw Hill Book Co., New York (1969).
-
(2) - TILAK (B.-V.), YEO (R.-S.), SRINIVASAN (S.) - Electrochemical Energy Conversion and Storage, dans Comprehensive Treatise of Electrochemistry. - J. O’M. Bockris, B.E. Conway, E. Yeager et R.E. White (Eds.), vol. 3, Plenum Press, New York (1981).
-
(3) - VIELSTICH (W.), GASTEIGER (H.), LAMM (A.) - Handbook of fuel cells: fundamentals and survey of systems. - Vol. 1, Wiley, Chichester (2003).
-
(4) - SØRENSEN (B.) - Hydrogen and Fuel Cell Emerging Technologies and Applications. - Elsevier Academic Press, New York (2005).
-
(5) - STOLTEN (D.) - Hydrogen and Fuel Cells, Fundamentals, Technologies and Applications. - Wiley-VCH, Weinheim (2010).
-
(6)...
DANS NOS BASES DOCUMENTAIRES
-
GENEPAC : pile à combustible PEMFC issue du partenariat PSA Peugeot Citroën (Stellantis) et CEA.
-
Piles à combustible PEMFC et SOFC – Description et gestion du système.
-
Piles à combustible PEMFC et SOFC – Transferts de chaleur et de masse.
-
Applications mobiles et stationnaires de l’hydrogène dans la transition énergétique.
Cet article fait partie de l’offre
Conversion de l'énergie électrique
(263 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive









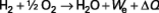 ( 2 )
( 2 )