Présentation
Auteur(s)
-
Anne-Marie ZAHRA : Ingénieur Montanuniversität Leoben - Doctor of Philosophy Imperial College London - Directeur de Recherche au Centre National de la Recherche Scientifique (CNRS)
-
Jean-Claude MATHIEU : Ingénieur de l’Institut National Polytechnique de Grenoble - Docteur ès Sciences - Directeur de Recherche au CNRS - Directeur du Centre de Thermodynamique et de Microcalorimétrie du CNRS
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le succès du développement de la thermodynamique classique dans ses applications aux états d’équilibre a toujours présenté un attrait pour les physico-chimistes confrontés au suivi quantitatif de l’évolution d’un système avec le temps. Il faut bien admettre que la cinétique chimique, par exemple, n’a que peu évolué sur le plan fondamental en l’absence d’un support conceptuel comparable en rigueur. En contrepartie, cette discipline trouve actuellement un nouvel élan issu des méthodes numériques de simulation.
Rechercher, avec des méthodes empruntées à la thermodynamique de l’équilibre, le comportement d’un système qui s’en écarte est l’objet de la thermodynamique des processus irréversibles (TPI). Ce moyen d’analyse a le mérite d’englober de façon unitaire un nombre considérable de phénomènes mesurables en sciences physiques et techniques (physique de l’état solide, des plasmas, hydrodynamique, aérodynamique, biophysique, biochimie, électrochimie et autres). À ce jour, son évolution réside dans la recherche de concepts statistiques susceptibles, comme en thermodynamique de l’équilibre, de rapprocher ses conclusions macroscopiques d’une causalité microscopique.
Historiquement, la thermodynamique des processus irréversibles n’a été développée qu’après la compréhension des processus à l’équilibre. Thomson (1854) fut le premier à avoir tenté une explication thermodynamique de l’effet thermoélectrique. La deuxième loi de la thermodynamique classique fut reformulée pour inclure les états hors équilibre ; le terme d’affinité fut introduit par de Donder. En 1931, Onsager établit le principe de réciprocité qui fut généralisé par Casimir. Ce théorème, de même que les autres formulés ultérieurement, ne peut être vérifié qu’expérimentalement.
La thermodynamique des processus irréversibles, dans le domaine de validité d’équations phénoménologiques linéaires, a été élaborée entre 1940 et 1962 par des Allemands (Meixner, Haase), des Belges (Prigogine, Glansdorff) et des Hollandais (de Groot, Mazur). L’extension à des phénomènes non linéaires est en constant progrès ; la description macroscopique est possible tant que l’équilibre local est maintenu. Glansdorff et Prigogine ont proposé une théorie unifiée de la thermodynamique et des fluctuations applicables à des processus réversibles ou irréversibles, voisins ou éloignés de l’état d’équilibre .
Cet article fait suite à l’article Thermodynamique macroscopique [A 223] de ce traité ; il se compose de deux parties, principes généraux et applications. Ici, nous nous limitons à la présentation de phénomènes relativement simples.
Deux types d’équations de base permettent de décrire les processus irréversibles, les relations phénoménologiques 1.2 et les équations de bilan 1.6. Chaque processus irréversible est caractérisé par une production d’entropie qui est nécessairement positive ; elle représente le produit d’un flux irréversible par une force thermodynamique. En première approximation, ces flux sont des fonctions linéaires des forces comme dans la loi de Fick applicable à la diffusion 2.2.1, de Fourier décrivant la conduction thermique 2.2.2 et d’Ohm exprimant la conduction électrique 2.2.5.4. Les couplages entre différents phénomènes, tels que la thermodiffusion 2.2.3, les effets thermoélectriques 2.2.5.5, thermomagnétiques et galvanomagnétiques 2.2.5.6, thermomécaniques 2.3.4 et électrocinétiques 2.3.5, sont d’une grande importance pratique.
L’analyse des processus naturels et des procédés industriels est parfois basée sur le concept d’exergie plutôt que sur les bilans énergétiques. L’exergie représente le travail maximal utile que peut produire un système sans provoquer de changement permanent dans l’état thermodynamique d’un autre système, mis à part le réservoir.
L’écart entre travail réel et travail maximal s’interprète comme une perte de rendement. La vitesse de la disparition de l’exergie dans un processus irréversible est égale à la vitesse de la création d’entropie multipliée par la température du réservoir.
Le principe de Curie permet de classer les phénomènes irréversibles selon leur caractère tensoriel :
-
les réactions chimiques et les phénomènes de relaxation font appel à des scalaires ;
-
la diffusion, les conductions thermique et électrique ainsi que leurs couplages sont décrits par des tenseurs de rang 1 ;
-
des tenseurs de rang 2 sont nécessaires pour représenter les phénomènes visqueux.
Nous retenons ici une autre classification en considérant la nature du système concerné :
-
un système homogène (uniforme) peut être le siège de réactions chimiques et de phénomènes de relaxation 2.1 ;
-
les phénomènes de transport ont lieu dans un système continu ; ceux-ci sont provoqués par des gradients des paramètres intensifs 2.2 ;
-
dans un système discontinu (composé de deux sous-systèmes homogènes), les phénomènes de différence de pression thermomoléculaire ainsi que les effets thermomécaniques et électrocinétiques sont observables 2.3.
Remarque :
La divergence d’un vecteur (ou tenseur du premier ordre) est un scalaire :
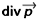 .
.
La divergence d’un tenseur du deuxième ordre est un vecteur :
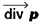 .
.
Le gradient d’un scalaire et un vecteur :
 .
.
Le gradient d’un vecteur est un tenseur du deuxième ordre :
 .
.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Principes généraux
Le bilan entropique joue un rôle essentiel ; le processus irréversible entraîne une production d’entropie qui est toujours positive et détermine la vitesse à laquelle il se déroule. Cette source d’entropie est la somme de termes dont chacun représente le produit d’un flux irréversible par une force thermodynamique et permet une description systématique des processus irréversibles.
1.1 Production d’entropie
Sous sa forme générale, le second principe de la thermodynamique traduit l’évolution d’un système par sa variation d’entropie dS. Celle-ci est la somme de deux termes de S lié aux échanges avec l’extérieur et di S traduisant les modifications internes du système, de sorte que :
Le terme di S ne peut être négatif. Lorsque le système ne subit que des transformations réversibles, di S est nul ; il est positif lorsque le système est le siège d’un processus irréversible :
Pour un système isolé qui ne peut échanger ni énergie ni matière avec l’extérieur :

Le partage de dS en deux termes permet une distinction facile entre les systèmes fermés qui échangent de l’énergie avec l’extérieur et les systèmes ouverts qui échangent à la fois énergie et matière ; la variation d’entropie contient de ce fait des termes supplémentaires.
L’analyse de l’évolution d’un système sous-entend la variable temps. La production d’entropie par unité de temps sera désignée par :
 ...
...Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Principes généraux
Cet article fait partie de l’offre
Physique Chimie
(204 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










