Présentation
RÉSUMÉ
Les gaz de synthèse s’appliquent à des mélanges gazeux susceptibles de se combiner pour réaliser la synthèse de composés organiques ou celle de l'ammoniac. Constitués des quatre éléments les plus répandus dans la nature (le carbone, l'oxygène, l'hydrogène et l'azote), ils sont essentiellement issus des hydrocarbures (gaz naturel ou plus rarement coupes pétrolières). Les matières premières les plus légères font l'objet d'une conversion catalytique, utilisant la vapeur d'eau comme oxydant, appelée vaporeformage. Les différentes opérations de production et de traitement entourant ce procédé englobent des étapes de purification et une étape de conversion du monoxyde de carbone dans le cas de l’hydrogène.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Jean-Paul MAZAUD : Ingénieur de l’École nationale supérieure de chimie de Toulouse (ENSCT) - Ingénieur en chef du service Procédés de la société SOFRESID
INTRODUCTION
Le terme gaz de synthèse peut prêter à une interprétation très vaste. En réalité, il est d’usage de considérer qu’il s’applique à des mélanges gazeux susceptibles de se combiner pour réaliser la synthèse de composés organiques ou celle de l’ammoniac.
On trouve systématiquement, dans les gaz de synthèse, deux ou plusieurs, combinés ou non, des quatre éléments les plus répandus dans la nature : le carbone, l’oxygène, l’hydrogène et l’azote. L’oxygène est pratiquement toujours combiné au carbone sous forme de monoxyde ou de dioxyde de carbone. L’hydrogène est le composant essentiel du gaz de synthèse. L’azote est indispensable à la synthèse de l’ammoniac, mais serait inerte dans le cas des synthèses de produits organiques.
Les hydrocarbures (gaz naturel ou coupes pétrolières) sont la source principale de gaz de synthèse (le lecteur se reportera au tableau synoptique Pétrochimie dans le présent traité).
L’utilisation du charbon, après le regain d’intérêt au milieu des années 80, reste totalement marginale.
Dans la fabrication du gaz de synthèse, on opère donc la transformation de C et/ou CnHm en CO, CO2 , H2 avec parfois addition de N2 , l’oxygène étant apporté soit directement, soit par la vapeur d’eau ou l’air.
— H2 purifié, débarrassé des composés du soufre éventuellement présents, de CO et de CO2 , est le composant essentiel de toutes les réactions d’hydrogénation.
— Le mélange CO + CO2 + H2 est à l’origine de la synthèse du méthanol.
— CO seul conduit aux réactions de carbonylation.
— Le mélange CO + H2 est la base des synthèses oxo.
— H2 et N2 , débarrassés de tous les composés oxygénés, permettent la synthèse de l’ammoniac, base essentielle de la chimie de l’acide nitrique et des engrais azotés.
Diverses voies de production de gaz de synthèse sont industriellement utilisées ; leur classement par ordre d’importance décroissante est le suivant :
-
reformage de gaz naturel ;
-
oxydation partielle de fuel lourd ;
-
reformage de naphta ;
-
oxyvapogazéification du charbon ;
-
oxydation partielle de gaz naturel.
Pour mémoire, citons l’obtention de gaz de biomasse par fermentation de déchets végétaux.
La production de gaz de synthèse par oxydation partielle des fuels lourds et par gazéification des combustibles fait l’objet de deux articles séparés dans le présent traité.
L’objet du présent article est l’étude des différentes opérations de production et de traitement des gaz de synthèse par la voie du reformage, sachant toutefois que certaines unités de ce traitement s’appliquent aussi aux installations produisant du gaz de synthèse par oxydation partielle de fuel lourd ou par gazéification de charbon. C’est le cas des unités de conversion et de décarbonatation.
Les années 80 ont vu se stabiliser, voire se réduire, les coûts de l’énergie conventionnelle (gaz et pétrole) dans le contexte d’un ralentissement généralisé de la croissance économique, qui réunit tous les éléments de frein à l’innovation et au développement des techniques. L’évolution technique des unités de production de gaz de synthèse a donc été relativement faible pendant cette période et, malgré une certaine reprise d’activité dans la première moitié de la décennie 90, il ne faut pas s’attendre à des révolutions techniques profondes pour la fin de ce siècle.
Dans ces périodes de difficultés, la tendance aux économies, amorcée à la suite des crises pétrolières, s’est accentuée : économiser l’énergie, c’est diminuer les coûts de production, c’est aussi lutter contre la pollution en diminuant les rejets dans l’atmosphère, serrer au plus près le dimensionnement des unités de production, rechercher des solutions techniques moins coûteuses, et également contribuer à réduire l’investissement.
Dans ces perspectives d’économie d’énergie, de lutte contre la pollution et de réduction des coûts d’investissement, les conceptions des unités de production de gaz de synthèse ont évolué et de nouveaux dispositifs ont été étudiés et mis en œuvre.
De plus, l’abondance du gaz naturel a pratiquement fait disparaître les autres matières premières (naphta, produits pétroliers lourds, charbon). L’utilisation du gaz naturel réunit les avantages d’un coût de production attractif, d’une pollution plus faible et d’un investissement moindre, les ateliers étant plus simples.
VERSIONS
- Version archivée 1 de sept. 1983 par Jean-Paul MAZAUD
- Version courante de févr. 2012 par Fabrice GIROUDIÈRE, André LE GALL
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
3. Conversion de CO par la vapeur d’eau
3.1 Présentation générale
La conversion du monoxyde de carbone par la vapeur d’eau constitue une source importante d’hydrogène et, de ce fait, trouve tout naturellement sa place dans la ligne de fabrication de gaz de synthèse.
Dans les unités classiques de production d’ammoniac par reformage de gaz naturel, cette réaction contribue pour environ 20 % à la production totale d’hydrogène, ce qui situe l’importance de cette étape.
La réaction de conversion du monoxyde de carbone par la vapeur d’eau est connue et mise en œuvre depuis fort longtemps. De nombreuses raisons ont fait considérer cette réaction du gaz à l’eau :
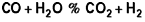
comme très classique, tout d’abord sa simplicité, puis l’absence de réactions secondaires.
Longuement étudiée au laboratoire, cette réaction voit son application industrielle croître sans cesse et se perfectionner, grâce à l’élaboration de nouveaux catalyseurs qui permettent des conditions opératoires plus sèvères, telles que présence de soufre, faible teneur en vapeur d’eau du mélange réactif, températures basses, etc.
Les bases thermodynamiques et cinétiques ainsi que les réacteurs de conversion sont décrits dans l’article Calcul des réacteurs catalytiques. IV. Conversion du monoxyde de carbone par la vapeur d’eau, dans ce traité.
3.2 Mise en œuvre et exploitation industrielles
-
Le schéma le plus classique est celui que l’on rencontre dans les ateliers de production de gaz de synthèse d’ammoniac par reformage à la vapeur de gaz naturel ou de naphta : il consiste en un premier réacteur catalytique de conversion à haute température (HT) suivi d’un refroidissement des gaz et d’un réacteur catalytique de conversion à basse température (BT).
-
On trouve des schémas différents dans le cas de production de gaz de synthèse par oxydation partielle des fuels lourds ou par gazéification...
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Conversion de CO par la vapeur d’eau
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










