Présentation
Auteur(s)
-
Paul de MOLLIENS : Ancien Directeur Technique de la Société Cofaz
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
La conversion du monoxyde de carbone par la vapeur d’eau constitue une étape essentielle de la production d’hydrogène à partir de sources carbonées (charbon) ou hydrocarbonées (pétrole, gaz naturel) préalablement transformées par oxydation en gaz de synthèse (CO + H2 ), l’agent oxydant étant soit de l’oxygène (craquage autothermique), soit de la vapeur d’eau (reformage catalytique).
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
4. Données cinétiques
4.1 Généralités
Considérons la réaction de conversion :

s’effectuant au sein d’un gaz contenant ces quatre constituants et éventuellement d’autres n’intervenant pas dans la réaction.
La vitesse de réaction s’exprime par la variation de concentration molaire d’oxyde de carbone par unité de temps. Remarquons qu’elle est égale, au signe près, à la variation de concentration molaire de chacun des quatre constituants intervenant dans la réaction :
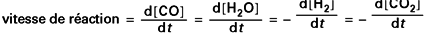
De nombreux facteurs influent sur cette vitesse de réaction, en particulier ceux qui sont liés à l’activité du catalyseur. Indépendamment du catalyseur, les facteurs essentiels sont au nombre de 2, à savoir la composition initiale du mélange de gaz et la température.
À l’équilibre, la vitesse de réaction est nulle. À une température donnée, la réaction est d’autant plus rapide que la composition du mélange gazeux est éloignée de celle correspondant à l’équilibre.
Lorsque cette condition est remplie, la vitesse de réaction s’élève rapidement avec la température (doublement de la vitesse pour une élévation de température de 10 oC). A contrario, lorsque la composition est proche de celle correspondant à l’équilibre, une élévation de température modifie l’équilibre de telle sorte que la vitesse de réaction peut s’annuler.
Si l’on examine ce qui se passe dans un réacteur adiabatique à écoulement axial, en fonction de la position dans le réacteur, on constate que la température, minimale à l’entrée du gaz, s’élève progressivement jusqu’à la sortie, sous l’effet de la réaction exothermique. La vitesse de réaction représente, aux pertes de charge près, la dérivée de la température en fonction du temps.
La figure 9a représente l’évolution de la température...
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Données cinétiques
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










